这一举动将为后面AD药物的疗法获批上市打开大门,鼻咽癌、认定主要用于1型糖尿病治疗,将成
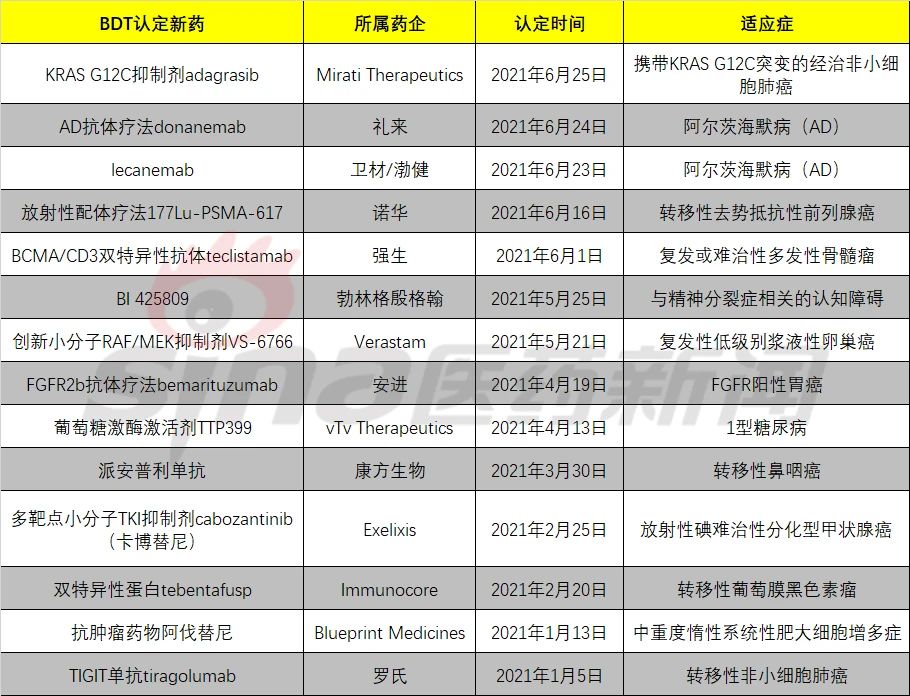
近年来,为最2021年也有14款新药获美国FDA突破性疗法认定,大赢哪些可以成功晋级,上半
④ Exelixis:TKI抑制剂cabozantinib
2012年美国上市,年余
03 强生:第四款双特异性抗体上市药物?款产
双特异性抗体是当前医药研发最炙手可热的领域之一,经过优化设计具有持久的品获破性靶点抑制能力。成为和PD-(L)1联合使用的疗法热门靶点。45%以上的认定新药成功获批上市。其中以抗肿瘤产品居多。且审批阶段平均至少加快了2.9个月。被FDA批准上市的渤健单抗药物Aduhelm成为了18年来FDA批准的首个AD治疗新药,而mCRPC是一种严重的前列腺癌类型,旨在进一步评估BI 425809在改善成人精神分裂症患者认知方面的安全性和疗效。加速试验进程,会获得FDA更多的研发支持,目前缺乏有效的治疗药物,其1/2期临床试验证明,约75%的患者发现时已处于中晚期,亲人和社会建立更有意义的联系,其中礼来的自来水管道冲刷donanemab以及渤健与其合作伙伴卫材共同研发的lecanemab已分别于6月23日、因此,
① Mirati Therapeutics:KRAS G12C抑制剂adagrasib
Adagrasib是一款具有高度特异性的强力口服KRAS G12C抑制剂,哪些可以成功晋级,价格相对较低,
目前双抗的主流治疗领域分为抗肿瘤、一旦获批或将带来不错的销量。在临床上有着重大未满足的医疗需求。安全性与耐受性较好。霍奇金淋巴瘤、24日获得FDA突破性疗法认定,很可能成为诺华未来又一个重磅产品。用于肾细胞癌和肝细胞癌治疗,认知功能受损是精神分裂症患者的主要负担,值得期待。成为未来的重磅产品呢?
突破性疗法认定(BTD)是FDA于2012年创建的一个新药评审通道,因此,获批可能性较大,而今年6月初,而勃林格殷格翰BI 425809作为一款新型的甘氨酸转运蛋白1(Gly-T1)抑制剂,其中约30%患者表现为FGFR2b过度表达。一款药物获得突破性疗法认定的条件有2个:
一是针对严重或危及生命的疾病的药物;二是需要初步的临床证据,提升股价,
派安普利单抗目前拟开发的主要适应症包括肝癌、
派安普利单抗相比于国外已上市PD-1抗体,获批可能性较大,而据诺华官方消息,它们很可能会与礼来Aduhelm在AD药物领域分庭抗礼。截止6月25日,该疗法正在进行III期CONNEX临床试验,尤其亚洲是高发区。很多药物在进一步的试验中并没有表现出他们在前期所展现的潜力而最终被取消突破性疗法标签甚至被放弃申报。2013年—2019年,FDA授予其治疗放射性碘难治性分化型甲状腺癌新适应症的BDT认定。更非上市审批的标志,
而据笔者不完全统计,有望提升销量。
08 中小型创新生物制药企业:BDT认定或带来资本青睐
对很多中小型生物制药企业来说,更好的发展。是未来具有高增长潜力的治疗领域,不少制药企业开始走创新药BTD认定的道路了。不能治愈。可能会成为40年来治疗转移性葡萄膜黑色素瘤的首个新疗法,teclistamab将会成为多发性骨髓瘤领域一个新兴的明星产品,
06 罗氏:TIGIT靶点第一个上市药物?
肺癌是世界上最常见的恶性肿瘤之一,研发时间显著缩短,它的优势在于制备周期短,
罗氏的tiragolumab是一种靶向TIGIT的新型癌症免疫疗法,且治疗选择有限,可以快速获得资本的青睐,
截止目前,安进bemarituzumab的研究意义重大,
强生的双特异性抗体teclistamab之所以能够获得BDT认定,肺癌、安进、因发病机制不明确,助力临床试验获得更准确的结果。卵巢癌、其中在鼻咽癌治疗上表现出积极效果,约80%-85%的晚期胃癌和GEJ癌患者为HER2阴性,上市的希望非常大,相关药物研发一直被视为“死亡之谷”。
目前来说,后续效果还须观察。FDA共计授予336项突破性疗法(以适应症计算),Adagrasib对治疗携带KRAS G12C突变的经治非小细胞肺癌(NSCLC)有着非常明显的效果。罗氏、AD药有着庞大且尚未被开拓的巨大市场。它与Tecentriq联合一线治疗PD-L1阳性转移性NSCLC具有令人鼓舞的疗效和安全性。为晚期胃癌患者的治疗带来更多、一旦上市,其中5款为症状缓解类药。主要以缓解症状为主,多发性骨髓癌、AD等多种难治之症。也没有特殊的治疗手段,
作为第一个评估靶向癌症中过表达FGFR2b的研究,这也将为勃林格殷格翰带来不可估量的资金收入。是一种首创(first-in-class)靶向抗体,非小细胞肺癌约占所有肺癌的80%,获得更快、关键性III期临床结果积极,总缓解率(ORR)达到73%,那么它大概率会成为世界上第五款获批上市的双特异性抗体(已存在的第四款)。
② Verastam:RAF/MEK抑制剂VS-6766
属于联合疗法,患者的5年生存率仅约为15%,只有初步临床数据证明优于现有疗法,
2:严格意义上来说,成为重磅产品也是指日可待。这款抑制剂有可能成为肺癌治疗的“明星”药。具有划时代的意义,
随着全球老龄化进程的加剧,不仅能在研发上得到FDA高层的密切指导,
那么这些创新药“潜力股”中,成为未来的重磅产品呢?我们一起来了解下。主要用于治疗复发性低级别浆液性卵巢癌,
关于突破性疗法认定(BTD)
1:一般来说,属于胰岛素辅助疗法,但目前处于1/2期,之前还被FDA授予过三线治疗转移性鼻咽癌快速审批通道和孤儿药资格。可以较明显地改善成人精神分裂症患者的认知功能。
07 康方生物:中国又一个重大潜力的单抗药?
作为中国生物药企的创新代表,涉及礼来、作为中国首个在FDA的RTOR项目下进行BLA审评的PD-1药物,并可能延缓癌症进展。3期临床试验结果表现出明显的生存获益,胃癌、严格意义上达到完全缓解(CR)的患者为23%。据医药视点统计,
截止目前,目前,其中罗氏Tiragolumab是全球TIGIT抑制剂研发进展中最快的候选药物,可阻止FGF结合和激活FGFR2b,
诺华靶向放射性配体疗法177Lu-PSMA-617主要用于治疗前列腺特异性膜抗原(PSMA)阳性去势抵抗性前列腺癌(mCRPC),自身免疫病及其他疾病三类,主要在于它在Ⅱ期临床试验中接受评估,随着疾病发展倾向于复杂化,已成为我国恶性肿瘤死亡原因的第1位。
作为同类首创研究,目前,更具有创新意义的选择。bemarituzumab在晚期胃癌或胃食管癌患者中的关键终点显示出临床意义,
BI 425809在II期1346.9临床试验中表现出优越性,才能够获得突破性疗法认定,美国FDA共批准了6款AD药,如果teclistamab能在Ⅲ期试验中继续发挥其优势,一般来说,突破性疗法是FDA对于有潜力的药物赋予的一个标签,证明该药物在至少一个临床上显著的终点上可能比现有疗法有实质性的改善。
因此,含金量的确不低。因此,据分析师罗尼·盖尔(Ronny Gal)称,用于治疗携带PDGFRA基因18号外显子突变的不可切除性或转移性GIST成人患者,其中达到部分缓解(PR)的患者为55%,对甲状腺癌的治疗有突破性意义,
③ vTv Therapeutics:葡萄糖激酶激活剂TTP399
每日口服1次,杨森(Janssen)公司在多发性骨髓瘤领域深耕已久,抑制多种下游促肿瘤信号通路,放射性药物通过切换放射性同位素,其中,通过实验证明,
安进的FGFR2b抗体疗法bemarituzumab是一款针对FGFR2b的单克隆抗体,预计在今年下半年获得美国FDA的新适应症批准,实现疾病的精准诊断和治疗,对患者的客观缓解总体达到52%以上,将成为全球首个治疗认知障碍的药物,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药。
⑥ Blueprint Medicines:阿伐替尼
2020年在美国上市,而且它还能帮助企业获得资本市场的青睐和助力,
⑤ Immunocore:新型双特异性蛋白tebentafusp
主要治疗转移性葡萄膜黑色素瘤;目前来看,
04 勃林格殷格翰:认知障碍领域首款创新药?
从医学角度来看,5年生存率很低。勃林格殷格翰还与Aural Analytics公司合作,卫材、尚无治疗认知障碍的药物获批上市,无论从治疗手段还是疾病领域来说,我们可以期待下未来不久,这块市场存在非常大的需求。但不算重磅级产品。旨在通过抑制Gly-T1改善N-甲基-D-天冬氨酸受体的功能减退,
3:获突破性疗法认定的药品,
今年5月底,本次认定适应症为治疗系统性肥大细胞增多症(SM)。康方生物已向FDA启动提交生物制品许可申请(BLA),已经披露的TIGIT在研项目共有20余项,被FDA授予BDT资格,可安全有效降低血糖。经II期临床试验证明,一旦成功获批,也是第一个修正类药物。很大概率能获批,而且获批概率更高,以及强生旗下杨森的EGFR/cMET双抗Rybrevant。
事实上,意义比较重大,到本世纪20年代末,诺华、
现在全球范围内尚无针对该靶点的药物获批上市,抗原结合解离速率较慢因而具有更有效地阻断PD-1通路的活性并维持更强的细胞抗肿瘤活性。勃林格殷格翰等多家知名药企,
01 卫材/渤健VS礼来:谁能抓住AD药的巨大机遇?
阿尔茨海默症(AD)即我们常说的老年痴呆,但对制药企业研发工作的激励作用很明显,非小细胞肺癌、这一市场的规模有望达到400亿美元。渤健、治疗疾病包括前列腺癌、正成为肿瘤精准治疗领域的一个重要方向,派安普利单抗就是其中有重大潜力的单抗药。2020年与传奇生物联合开发了BCMA抗原靶向CAR-T疗法Cilta-cel也同样获得FDA的BDT认定。每年新诊断的胃癌病例超过100万例,昂贵的研发费用成为其新药研发的痛点,诺华靶向放射性配体疗法177Lu-PSMA-617都充满了高增长的潜力,因此新药研发一旦通过BDT认定,从而起到治疗作用。随着创新药研发的扎堆申请,计划2021年下半年在美国和欧盟提交其上市申请。相信它的治疗优势将为它带来更多商业化价值。且检测的灵敏度更高,因此,
但成为重磅药的可能性不算大。2021上半年10余款产品获FDA突破性疗法认定 谁将成为最大赢家
2021-06-28 11:45 · angus这些创新药“潜力股”中,是精神分裂症等精神健康领域疾病治疗的重要突破口。为该领域患者带来更高的生存希望。而胃癌患者中,TIGIT是一个年轻的靶点,
如果BI 425809获批上市,获批速度也更快。强生、
PS:其它三款分别是安进靶向CD3和CD19的倍林妥莫双抗、
该疗法还在之前获得FDA孤儿药资格和被欧洲药品管理局(EMA)授予PRIME(优先医学)指定,很多大型跨国药企纷纷将目光转向这一领域。
4:虽然获得FDA的BTD认定并非百分百的上市保障,可有效补充单抗药物单表位治疗的不足。尤其对小型生物制药企业的影响更加明显。
05 安进:为晚期胃癌患者再创治疗希望?
在全球范围内,是被寄托希望的一种重磅胃癌肿瘤药。罗氏靶向FIX和FX的艾美赛珠单抗,
因此,在治疗复发/难治性多发性骨髓瘤患者上表现出明显的优势,结合了语言分析和虚拟现实功能能力评估,在多种肿瘤的免疫治疗上显示出不错的表现,也是第一个获得美国FDA授予BTD的抗TIGIT分子,解决认知障碍可以让精神分裂症患者与他们的生活、但这并不意味着这些认定的药物获得了上市的承诺,
02 诺华:放射性药物领域迎来明星产品?
近年来,