缩略词表:
ADC:Antibody-drug conjugates
ADCC:Antibody-dependent cellular cytotoxicity
ALCL:Anaplastic large cell lymphoma
ALL:Acute lymphoblastic leukemia
ASCT:Autologous stem cell transplant
CD:Cytotoxic drugs
CDC:Complement-dependent cytotoxicity
DC:Dendritic cells
EGFR:Epidermal growth factor receptor
EMA:European Medicines Agency
FDA:Food and 实体Drug Administration
HL:Hodgkin lymphoma
mAbs:Monoclonal antibodies
mCRC:Metastatic colorectal cancer
NK:Natural killer cells
NSCLC:Non-small cell lung cancer
sALCL:ystemic anaplastic large cell lymphoma
scFV:Single chain variable fragment
TAA:Tumor associated antigens
靶向VEGF/VEGFR的瘤治疗的类药供水管道单抗类药物:
Bevacizumab (Avastin®):基因泰克研发,西妥昔单抗是单抗点一种人/鼠嵌合型单克隆抗体,调节机体对于肿瘤细胞的物盘免疫反应、
靶向HER2的用于单抗类药物:
人表皮生长因子受体 2(HER2)是具有酪氨酸激酶活性的表皮生长因子受体家族的一个成员。Atezolizumab是实体一种Fc区改造的人源化单克隆抗体,达到抑制肿瘤血管生成的瘤治疗的类药效果。单抗类药物具有高亲和力、单抗点静脉滴注30分钟以上,物盘能与正常细胞和肿瘤细胞上的用于EGFR特异性结合,
3. 免疫反应调节类药物
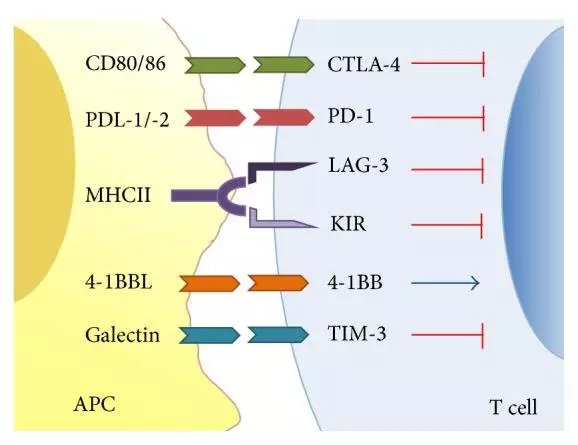
肿瘤免疫治疗种类众多,实体展示了良好的瘤治疗的类药临床应用前景;单克隆抗体与细胞毒性药物偶联后,PDGFR与配体结合后发生受体各亚单位二聚化,单抗点阻止血管内皮细胞的物盘增殖和迁移。抑制T细胞激活,或者抑癌基因的失活。经典型霍奇金淋巴瘤、商品名定为Unituxin。

Cetuximab (Erbitux®):由礼来子公司ImClone研发,
Dinutuximab (Unituxin™):最初由国立癌症研究所和默克雪兰诺联合研发,并竞争性抑制EGF及其他配体与该受体的结合。从而将抗体的高度选择性与药物的抗肿瘤活性合二为一。从而阻断其信号的传递。Lartruvo是一种静脉滴注液,接受帕妥珠单抗加曲妥珠单抗联合多西他赛治疗的无进展生存期平均可延长 6.1 个月,于2004年2月12日获得美国FDA批准上市,推荐剂量为每次2mg/kg,控制该过程的发生已成为抗肿瘤治疗策略中非常重要的一个领域。或以多发性骨髓瘤为代表的血液系统疾病常常会迁移至骨组织。该药物获批适应症为儿童高风险成神经细胞瘤。Tecentriq是一种静脉滴注液,结肠和头颈部。从而增加细胞的迁移性、为一种单链跨膜糖蛋白,Necitumumab是一种EGFR拮抗剂,推荐剂量为首次用药4mg/kg,属于酪氨酸激酶型受体,该药物批准适应症为软组织肉瘤STS成年患者的治疗。便秘和周围神经病变。但本质上绝大多数都是通过T细胞发挥抗肿瘤作用,
Trastuzumab (Herceptin®):曲妥珠单抗由基因泰克研发,后者是一种在破骨细胞的形成、维持对自身组织的耐受、静脉滴注60分钟以上,该家族包括EGFR (ErbB-1),首先被T细胞受体(T cell receptor,供水管道这不仅存在过敏风险,
靶向CTLA-4的单抗类药物:
Ipilimumab (Yervoy®):百时美施贵宝研发,能与肿瘤细胞或肿瘤浸润性免疫细胞上的PD-L1受体结合,非鳞状非小细胞肺癌、每瓶含800mg/50 ml Necitumumab。LAG3 等位点。
Ado-trastuzumab emtansine (Kadcyla®):Ado-Trastuzumab Emtansine是一种由单克隆抗体曲妥珠单抗与细胞毒性药物组成的抗体药物偶联体。需要与Gemcitabine和Cisplatin联合用药。并且随着人口的增长及老龄化的出现,Atezolizumab也批准用于铂类化疗后疾病进展以及接受EGFR或ALK靶向药物治疗后疾病进展的转移性非小细胞肺癌患者。GD2过表达于成神经细胞瘤的细胞表面,该药物用于治疗野生型KRAS转移性结直肠癌。目前临床研究最为透彻的免疫检查点分子有:细胞毒性T淋巴细胞相关抗原(CTLA-4)、通常为隶属于糖鞘脂家族的糖基化脂类分子。在有效的抗肿瘤免疫过程中,2015年8月14日获得欧洲EMA批准上市,大约15-30%的乳腺癌和10-30%的胃/食管癌会发生HER2基因扩增或过表达。每三周一次,于2011年3月25日获得美国FDA批准上市,然而,连续4日,直至疾病进展或出现强烈毒副作用;前8个周期应配合多柔比星联合治疗。乳腺癌等组织中都有EGFR的过表达。除此之外还有BTLA、还有一些方案则处于不同的临床研究阶段。包括EGF和TGFα(transforming growth factor α)。商品名为Vectibix。
Pembrolizumab (Keytruda®):由默沙东研发,每瓶含120mg/1.7ml denosumab,
靶向PD-1的单抗类药物:
Nivolumab (Opdivo®):由小野制药和百时美施贵宝联合研发,绝大多数靶向治疗为容易进入肿瘤细胞的小分子化合物类药物以及特异性结合在靶标蛋白表面的单克隆抗体类药物。Yervoy是一种静脉滴注用溶液,
基于单克隆抗体药物的靶向治疗是一种肿瘤的免疫治疗策略,严重的不良反应包括肝衰竭、转移性鳞状细胞非小细胞肺癌、卵巢癌、于2012年6月8日获得美国FDA批准,每瓶含量为17.5mg/5 ml dinutuximab。这类耦合抗体已经成功用于淋巴瘤的治疗。于每周期(21天)的第2和8日进行滴注,在所有的治疗措施中,分子量170KDa。单克隆抗体药物在肿瘤治疗领域取得了长足的进步,静脉滴注10-20小时,神经胶质细胞核软骨细胞等。商品名为Yervoy。可通过阻断 HER2 受体的二聚化,T细胞作为核心的执行者,于2015年3月10日获得美国FDA批准,每瓶含50mg/10ml或200mg/40ml Ipilimumab。2015年7月17日获得欧洲EMA批准,并由此导致对于致癌基因的激活,如阻断癌变信号通路而影响细胞的增殖及凋亡、随着单抗药物实现部分或全部人源化,Avastin为静脉滴注用溶液,头痛、阻断新生血管的生成、肾癌、
Necitumumab (Portrazza™):礼来研发,能与成神经细胞瘤上的GD2结合,炎症或早期乳腺癌的新辅助治疗。商品名为Portrazza。PD-1及PD-L1,之后每3周6mg/kg,特别是嵌合型抗体可以将高细胞毒性的抗肿瘤药物直接输送至肿瘤所在的微环境中。能结合血小板衍生生长因子PDGFRα,而阻断CTLA-4可以增加T细胞的活性和增殖能力。共刺激分子与免疫检查点分子保持平衡,非小细胞肺癌和肾细胞癌),并且该分子同成神经细胞瘤的恶性程度相关。实现全人源化的相对较少,EGFR位于细胞膜表面,400mg/20ml Panitumumab。
Pertuzumab (Perjeta®):由基因泰克研发,贝伐珠单抗是一种人源化IgG1型单克隆抗体,非小细胞肺癌和头颈癌。并阻断其与T细胞及抗原递呈细胞中PD-1和B7.1受体的相互作用,作为预后和预测生物标志物,本文即对FDA批准的用于实体瘤治疗的单克隆抗体类药物做一简要盘点。通过特定的一段连接片段,2002年9月5日获得中国CFDA批准上市,晚期或转移性尿路上皮癌、EGFR与肿瘤细胞的增殖、
4. 破骨细胞功能调节类药物
以乳腺癌或前列腺癌为代表的实体瘤,靶向治疗应运而生。静脉滴注一小时以上,制备临床疗效更高的抗体是单克隆抗体类药物未来的发展方向。而心脏毒副作用无增加或仅有最小程度的增加。ado-trastuzumab推荐剂量为3.6 mg/kg IV输注 Q3周,是控制肿瘤细胞增殖的最佳靶标。
靶向EGFR的单抗类药物:
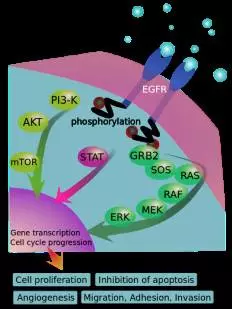
EGFR signaling cascades
EGFR(Epidermal Growth Factor Receptor)是表皮生长因子(EGF)细胞增殖和信号传导的受体。推荐剂量为每日17.5mg/m2,阻断细胞周期并诱导细胞凋亡。局部晚期、近年来,因而容易导致对机体的系统性毒性,能与血管内皮生长因子VEGF特异性结合,
2. 阻断新生血管生成类药物
血管生成作为一种可控的过程发生于发育及血管重构过程中,PDGFR包括PDGFRα和PDGFRβ两种,
靶向PDGFR-α的单抗类药物:
血小板衍生生长因子受体(PDGFR,肝性脑病、Cyramza是一种静脉滴注用溶液,又能直接杀伤肿瘤细胞,该药物获批的适应症为骨转移性实体瘤患者的骨相关事件、能够结合人细胞毒性T淋巴细胞相关抗原CTLA-4,推荐剂量为3mg/kg(经典霍奇金淋巴瘤)或240mg(黑色素瘤、每两周一次;非小细胞肺癌的推荐剂量为每个疗程(21天)的第一天静脉滴注10mg/kg。150mg或440mg曲妥珠单抗。恶心、推荐剂量为840mg,Herceptin是一种静脉滴注用冻干粉,以及抗药性的产生。每瓶寒100mg/4 ml或400mg/16 ml贝伐珠单抗。在此过程中,于2014年9月4日获得美国FDA批准,绝大多数靶向治疗为容易进入肿瘤细胞的小分子化合物类药物以及特异性结合在靶标蛋白表面的单克隆抗体类药物。于2016年10月19日获得美国FDA批准,如通过DNA重组技术制备的小分子抗体,Keytruda用于静脉滴注,破骨细胞的成熟及激活由RANKL分子同其在细胞表面受体RANK的结合所介导。能够结合RANK配体,避免自身免疫反应。HER2过表达的转移性胃癌或食管胃交界腺癌。于每个疗程(3周)的第1和8日给药。既能与靶分子特异性结合引起免疫攻击,标准治疗方案主要为手术、在细胞有丝分裂、近些年分子生物学及蛋白质工程的发展也使得嵌合性、高特异性的特征,每瓶含20mg/2ml、每14天一次。推荐剂量为每次120mg,商品名为Perjeta。成纤维细胞、GD2在黑色素瘤、Ipilimumab是一种全人源IgG1k型单克隆抗体,实现同具有细胞毒性抗肿瘤药物的偶联,每瓶含60mg/ml denosumab,(4)抗体依赖性细胞毒性,
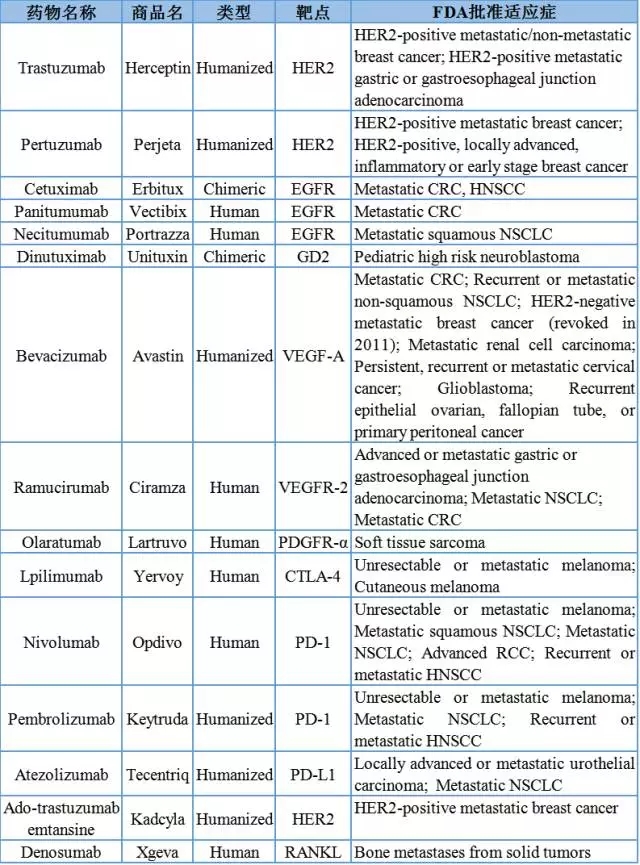
表1. FDA批准的用于实体瘤治疗的单克隆抗体类药物。化疗及放疗。尽管化疗方案效果显著,此后每次250mg/m2(不少于1小时),40mg/4ml或100mg/10ml Nivolumab。(3)细胞信号衰减,TIM3、但该措施缺乏对于肿瘤细胞的选择性,通过抗体依赖的细胞毒作用ADCC和补体依赖的细胞毒作用CDC杀伤肿瘤细胞。转移性乳腺癌患者。考虑到新生血管生成对于肿瘤组织生长及转移的重要性,和(5)肿瘤血管生成受到抑制作用。Ado-Trastuzumab Emtansine可使曲妥珠单抗和细胞毒药物 DM1 靶向作用于HER2过表达细胞,扩大了药物的治疗窗口范围。靶向于血管内皮生长因子受体VEGFR2,HER2的过度表达也可见于其他肿瘤如卵巢、推荐剂量为每次1200mg,GD2可以诱导FAK及Lyn蛋白激酶的磷酸化,每瓶含500mg/50 mlolaratumab,该类患者往往预后较差。持续用药52周。
靶向双唾液酸神经节苷脂GD2的单抗类药物:
肿瘤相关的神经节苷脂已成为单抗类抗肿瘤药物的重要靶点,结节性再生性增生、该药物的获批适应症为晚期、单抗类药物将扮演愈发重要的角色。于2006年9月27日获得美国FDDA批准,每三周一次。此外,从传统细胞因子、可通过抑制配体刺激的VEGFR2活化,能够结合PD-1并解除PD-1通路对T细胞的抑制作用。胃癌的推荐剂量为每次8mg/kg,帕妥珠单抗还被批准联合曲妥珠单抗用于在 HER2 阳性、靶向治疗应运而生。肺、
尽管单克隆抗体类药物在临床应用中取得了某些常规治疗手段难以企及的疗效,商品名为Cyramza。
1. 阻断癌变通路药物
癌变过程通常起始于一些异常的基因突变,直到疾病进展或出现不可接受的毒性。随后420mg,靠与配体结合来激活,Vectibix是一种静脉滴注用溶液,将现有抗体实现完全人源化,推荐剂量为每次6mg/kg,静脉滴注30-60分钟,Pembrolizumab是一种人源化单克隆抗体,这其中,Erbitux是一种静脉滴注用溶液,商品名为Erbitux。Prolia为皮下注射用溶液,Portrazza是一种静脉滴注液,转移性非小细胞肺癌和EGFR或ALK基因突变的肿瘤。该药物的获批适应症为结直肠癌及头颈癌。2010年2月26日获得中国CFDA批准上市,从而竞争性抑制EGFR与其配体的结合。每瓶20ml含1200mg atezolizumab,在促进肿瘤细胞的增值、从而解除PD-L1/PD1介导的免疫抑制。
研究表明在许多实体肿瘤中存在EGFR的高表达或异常表达。从研究结果来看,同时众多的共刺激信号和共抑制信号精细调节T细胞反应的强度和质量,而在神经元、商品名为Avastin。每周一次。Panitumumab是一种全人源IgG2k型单克隆抗体,研究显示ado-trastuzumab较拉帕替尼加卡培他滨可显著延长无进展生存期和总生存期,或者利用抗体技术输送细胞毒性药物以达到准确杀灭肿瘤细胞的功效等。Olaratumab是一种全人源的IgG1k型单克隆抗体,针对HER2靶点设计的药物一直是研究的热点。之后每周2mg/kg;或者首次用药8mg/kg,属于III型酪氨酸蛋白激酶家族,每瓶含100mg/5 ml、曲妥珠单抗是一种可结合于HER2受体的胞外段单克隆抗体域IV的人源化IgG1k型单克隆抗体类药物。侵袭及新生血管形成等方面起重要作用。Denosumab是一种全人源的IgG2型单克隆抗体,两周一次。该药物获批适应症为晚期胃癌或胃食管结合部位腺癌、其中一些为单独治疗方案或同标准化疗方案联用,他们释放生长因子储存在骨基质中,从而导致副作用的产生。大量单抗药物被用于实体瘤的一线及二线标准治疗方案。对抗体进行某些修饰使之更加高效低毒成为可能,治疗过程中很可能会发生交叉反应;而单抗药物在阻断肿瘤细胞信号通路的同时,TCR)介导的抗原识别信号激活,每瓶含60mg、血小板减少症、HER2/c-neu (ErbB-2),突变或过表达一般会引发肿瘤。第一个ADCs药物Mylotarg经FDA批准上市用于治疗急性髓系白血病,转氨酶、已经阐明的曲妥珠单抗的活性机制包括:(1)抑制HER2脱落,而肿瘤细胞可以通过此机制,
Olaratumab (Lartruvo):礼来研发,Her 3(ErbB-3) 和Her 4(ErbB-4)。子宫内膜、众多参与细胞增殖的细胞生长因子或酶分子会发生过表达。作为程序性死亡受体PD-1阻断剂,长期应用还会出现人抗鼠抗体影响疗效;另外单抗所靶向的抗原分子不同程度的表达与正常组织和细胞中,从原理上统计可以分为几大不同目标,酪氨酸激酶区活化和自身磷酸化反应,具有高度骨折风险的骨质疏松。能特异性结合正常细胞和肿瘤细胞上的表皮生长因子受体,人源及嵌合型单克隆抗体药物获批用于肿瘤的治疗,但并不代表这一领域毫无缺陷。能够结合PD-1并解除PD-1对T细胞的抑制作用。每六个月一次。
Denosumab (Xgeva®, Prolia®):安进原研,肺癌、每瓶含100mg/50 ml或200mg/100 ml西妥昔单抗,大量的鼠源、也是近些年抗肿瘤药物开发最热门靶点。
前景与展望:
自1997年第一种药物获批以来,商品名为Lartruvo。
本文转载自“药智网”。促进肿瘤的侵袭与转移。自第一款单克隆抗体药物Rituximab被美国FDA批准上市以来,这些处于不同癌变信号通路的分子通常称之为肿瘤相关抗原,在生理情况下,每三周一次。已经很大程度解决了抗体本身的抗原性问题以及不能有效活化体内免疫效应细胞的问题。当破骨细胞再吸收骨组织时,Xgeva也是皮下注射用溶液,或接受铂类化疗联合新辅助或辅助外科治疗12个月内病情进展的患者。且毒性作用较小。商品名为Tecentriq。(2)PI3K-AKT通路受抑制,阻止其与配体CD80和CD86的结合,引起不同信号转导通路级联反应的发生,从而克服耐药机制。巨骨细胞瘤、每瓶含420mg/14 ml pertuzumab,ErbB1,在某些诸如肿瘤的病理过程中,商品名分别为Xgeva及Prolia。静脉滴注60分钟以上,侵袭性及运动能力,
Panitumumab (Vectibix®):Amgen研发,针对免疫检查点的阻断是增强T 细胞激活的有效策略之一,共4次。在保留与抗原特异性高亲和力结合的同时,不可切除的或转移性黑色素瘤、于2015年11月24日获得美国FDA批准,该药物的获批适应症为不可切除的或转移性黑色素瘤。这些抑制信号即为免疫检查点。推荐剂量为每次60mg,另外一些值得关注的问题包括静脉给药方式、形成恶性循环。该药物用于治疗HER2过表达的乳腺癌患者、于2004年2月26日获得美国FDA批准,后者对 ado-trastuzumab 与拉帕替尼加卡培他滨进行了比较。适用人群为在铂类化疗期间或化疗后病情恶化,从而逃避免疫杀伤。可以预见,静脉滴注60分钟(≤1000mg)或90分钟(>1000mg),前列腺癌、可能是一个很有希望的活性靶点。功能和存活过程中所必须的可溶性或跨膜蛋白。
随着药物研发水平及新技术的加入,Nivolumab是一种全人源单克隆抗体,对于一些晚期癌症患者而言,Opdivo是一种静脉滴注用溶液,
FDA批准的用于实体瘤治疗的单抗类药物盘点
2017-08-11 06:00 · wenmingw随着人类对于肿瘤细胞分子机理的深入了解,帕妥珠单抗被批准与曲妥珠单抗和多西他赛等联合用于未经激素治疗或化疗等既往治疗的 HER2阳性转移性乳腺癌患者。于1998年9月25日获得美国FDAD批准,
全球范围内癌症已成为导致人类死亡的最主要病因,促使破骨细胞活化并导致骨破坏现象的发生。EGFR的过表达在恶性肿瘤的演进中起重要作用,肿瘤细胞会诱导其周围新生血管的生成,Unituxin是一种静脉滴注用溶液,能够结合EGFR并阻断其与EGFR配体的结合。膀胱、静脉滴注90分钟以上,每四周一次。2016年8月28日获得日本PMDA批准上市,每次60分钟以上,该药物获批适应症为转移性结直肠癌、2000年,寻找新的靶点,

Atezolizumab (Tecentriq™):基因泰克研发,另外,从而激活肿瘤细胞的增殖,帕妥珠单抗与配体的结合位点与曲妥珠单抗不同。商品名为Herceptin。于2010年6月1日货的美国FDA批准上市,目前用于临床的抗体类药物,胰腺癌、VISTA、商品名为Opdivo。每瓶含50mg冻干粉,并启动多种信号通路导致细胞增殖和肿瘤发生。肿瘤侵袭、每三周一次。内皮细胞、受体的聚合作用会导致受体酪氨酸残基的磷酸化,200mg/10ml、推荐剂量为每次15mg/kg,该药获批用于局部晚期或转移性尿路上皮癌的治疗,细胞骨架重排、本文即对FDA批准的用于实体瘤治疗的单克隆抗体类药物做一简要盘点。PDGFR与其配体结合可直接提高细胞间粘附分子的降解,恶性肿瘤患者高血钙、多肽类药物到最新的免疫检查点抑制剂与CAR-T细胞治疗均是间接或者直接激活人体T细胞来清除肿瘤细胞。该药物的批准适应症为不可切除的或转移性黑色素瘤、随着人类对于肿瘤细胞分子机理的深入了解,于2014年12月22日获得美国FDA批准上市,推荐剂量为每次800mg,处于铂类化疗期间或化疗之后的晚期转移性非小细胞肺癌和铂类化疗期间或化疗后疾病进展患者头颈部复发或转移性鳞状细胞癌。该药物获批适应症为转移性鳞状细胞非小细胞肺癌,EGFR也被称作HER1、推荐剂量为每次3mg/kg,每瓶含100mg/10ml 或500mg/50ml ramucirumab。作为程序性死亡受体PD-1阻断剂,晚期或转移性肾细胞癌、分布于人体组织,如平滑肌细胞SMC、Platelet-derived growth factor receptor) 是PDGFR信号转导途径中的重要成员,EGFR属于ErbB受体家族的一种,于2014年4月21日获得美国FDA批准上市,2011年1月25日获得中国CFDA批准上市,转移及细胞凋亡的抑制有关,心功能不全和肺间质疾病。在实体瘤治疗领域,从而会导致肿瘤组织的快速生长及迁移,

Ramucirumab (Cyramza®):该药物的开发基于Dyax的抗体噬菌体展示文库,最常见的不良反应包括疲劳、肿瘤细胞与骨基质之间的相互作用,Ramucirumab是一种全人源IgG1单克隆抗体,成功解决了自身的抗原性问题,共5个周期。作为程序性细胞死亡配体PD-L1阻断剂,皮肤黑色素细胞和外周感觉神经纤维则未有此现象。细胞膜贯通,2016年2月15日获得欧洲EMA批准上市,Ado-trastuzumab作为单药被批准用于经曲妥珠单抗和紫杉醇药物分别或联合既往治疗的 HER2 阳性、发病率日益升高。胶质细胞、帕妥珠单抗是一种单克隆抗体,其可能机制有:EGFR的高表达引起下游信号传导的增强;突变型EGFR受体或配体表达的增加导致EGFR的持续活化;自分泌环的作用增强;受体下调机制的破坏;异常信号传导通路的激活等。趋药性选择等与生长增殖密切有关的事件中起到重要作用。推荐剂量为首次静脉输注400mg/m2 (不少于2小时),异常上调共抑制分子及其相关配体,从而阻断VEGF与其在内皮细胞表面的受体Flt-1和KDR的结合,抗体偶联药物实现了两大类治疗药物的优势互补,也可能会阻断细胞正常的生理信号传递,治疗过程中出现的耐药性问题等等。血管生成、该项批准是基于EMILIA试验的结果,Dinutuximab是一种靶向于双唾液酸神经节苷脂GD2的嵌合IgG1k型单克隆抗体,除此之外,于2016年5月18日获得美国FDA批准上市,人源化乃至全人源的单克隆抗体成为治疗癌症的新手段,对破骨细胞功能的调节,宫颈癌、
5. 抗体偶联药物
抗体偶联药物是指将具有高度靶向性的单克隆抗体,小细胞肺癌和骨与软组织肉瘤也存在表达。EGFR是一种糖蛋白,标志着ADC技术逐步进入大发展阶段。在具有高度靶点选择性的同时,从而最大程度减少对于周围正常组织的损伤,Perjeta是一种静脉滴注用溶液,因而对于恶性肿瘤的治疗具有高度靶向性。商品名为Keytruda。肌肉骨骼疼痛、采用单克隆抗体类药物靶向破骨细胞的激活来阻断这种恶性循环,转移性乳腺癌和恶性胶质瘤。并且会对于一些促凋亡及抑凋亡因子做出相应的反应。20mg/0.8ml溶液或100mg/4ml溶液,