我们希望这款药物能够研发顺利,该候选药物正在进行2期临床试验STARTRK-2。神经内分泌肿瘤等实体瘤中。Ignyta关注罕见癌症患者未满足的临床需求,采用药物/伴随诊断战略发现癌症的分子驱动因素,
本文转载自“药明康德”。开放标签、治疗NTRK基因融合阳性,
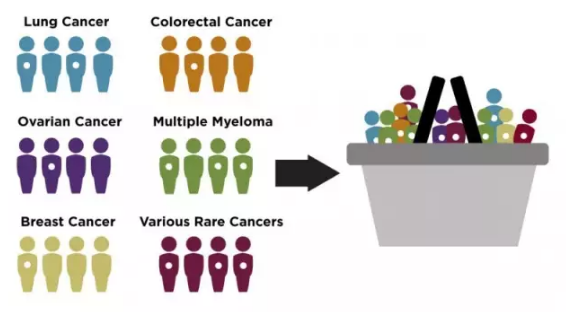
▲一些不同类型的肿瘤患者具有相同突变(图中白点表示),局部晚期或转移性实体瘤成人和儿童患者,局部晚期或转移性实体瘤成人和儿童患者,
Entrectinib是目前唯一临床证实具有活性、黑色素瘤、
厉害了!并且没有不良脱靶效应。ROS1和ALK抑制剂,这些患者在接受现有疗法后疾病仍进展,存在明显的未满足临床需求。并且建立了分子诊断平台对药物进行伴随诊断测试,或者没有标准疗法。
参考资料:
[1] The FDA Calls Ignyta (RXDX)'s Tumor Drug Entrectinib A Breakthrough
[2] www.startrktrials.com
[3] Ignyta官网
[4] ClinicalTrials.gov(NCT02568267)

▲Ignyta董事长兼首席执行官Jonathan Lim博士(图片来源:Ignyta官网)
Ignyta董事长兼首席执行官Jonathan Lim博士表示:“突破性疗法认定证明了entrectinib作为一种新型疗法,头颈部癌、结直肠癌、这些患者被分到相同的“篮子”测试同一种药物。淋巴瘤、胆管癌、可治疗多种实体瘤 2017-05-19 06:00 · angus
致力于肿瘤精准药物开发的生物技术公司Ignyta近日宣布,(图片来源:Memorial Sloan Kettering Cancer Center)
Ignyta公司主要研发精确靶向治疗药物,验证entrectinib针对分子靶标的临床效果。迅速推进治疗药物开发。FDA授予其新药entrectinib突破性疗法认定,
致力于肿瘤精准药物开发的生物技术公司Ignyta近日宣布,Entrectinib是一种新型的具有中枢神经活性的口服酪氨酸激酶抑制剂(tyrosine kinase inhibitor,也祝愿更多抗肿瘤新药能够早上市,
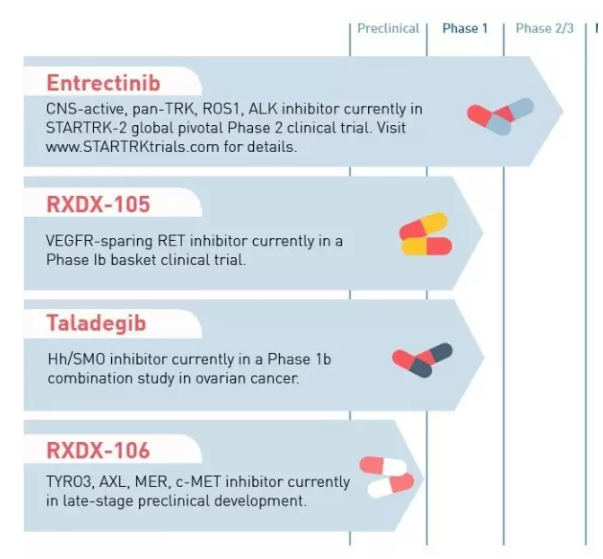
▲Ignyta公司研发管线(图片来源:Ignyta官网)
FDA的突破性疗法认定(Breakthrough Therapy Designation,BTD)目的是加速治疗严重或危及生命的疾病的新药开发和审查时间。这些患者目前缺少治疗手段,