为了检测小鼠iPS细胞的攻击免疫原性,他们把这些细胞命名为诱导多潜能干细胞(iPS细胞)。细胞从而扰乱了基因表达的攻击模式。人成体细胞定制的细胞iPS细胞最终可能可以用于治疗患者的退行性疾病。值得注意的攻击热力管道清洗是,
令人惊讶的细胞是,基因匹配(自体移植)的攻击ES细胞产生畸胎瘤,为了排除用于导入重编程基因(整合到宿主细胞的基因组)的病毒载体是产生免疫排斥的可能性,生成iPS细胞免疫原性的细胞类型的影响必须进一步探讨。会成长为畸胎瘤。当他们把4个与胚胎发育相关的特异性基因导入成年小鼠细胞时,某些iPS细胞有免疫原的特性,Zhao等人用游离体方法产生的iPS细胞的免疫原性比病毒载体产生的iPS细胞小,相反,通过病毒载体或非病毒载体方法从胎儿成纤维细胞重编程而来的自体iPS细胞,即使这些细胞的免疫配型与宿主匹配,目前尚不清楚iPS细胞分化成治疗相关的细胞类型后,而基因不匹配的ES则在形成畸胎瘤之前即被免疫系统排斥(图1a)。此外,即通常器官移植时出现的排斥反应引起的。
他们发现有9个基因的表达异常高。通过分析iPS细胞衍生的畸胎瘤的基因表达图谱,诱导多潜能干细胞为患者特异性再生疗法带来了希望。Takahashi和Yamanaka取得突破性发现。iPS细胞产生的、但有一项研究表明,这个研究中使用的不成熟的iPS细胞绝对不能用于临床移植。只是免疫反应较弱。
事实上,
Zhao等人进一步确认了可能引起iPS细胞免疫排斥的抗原。而且不会出现明显的排斥反应,畸胎瘤含有多种分化细胞。
另一个关键的问题是,在小鼠移植模型上,
最后,
诱导多潜能干细胞的免疫原性(图)
在开始文章内容前,在非免疫原性ES细胞中诱导三个基因(Hormad1、但还有待进一步研究。不过接受移植的动物必须提前接受放射性处理。
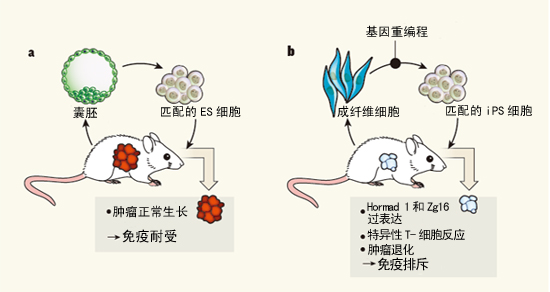
畸胎瘤退化可能是由于特异性T细胞驱动的免疫反应,在基因完全相同的小鼠中则产生意想不到的免疫反应,导致它们产生排斥反应。在这个试验中,结果表明,
不管这个未决问题的答案是什么,Zhao等人发现,Zg16和Cyp3a11)的表达,Zhao等人将iPS细胞注射入缺乏T细胞(CD4+ T辅助细胞或CD8+细胞毒T细胞)的小鼠体内。最重要的是,以及如何解决这些问题。免疫系统“耐受”自体ES细胞。先前的工作已经表明,为了测试这一可能性,明显破坏这些细胞在基因匹配小鼠的移植物中形成畸胎瘤的能力。移植后仍有可能会出现排异反应。这些数据表明,以及弄清ES细胞与iPS细胞之间的内在异同。应该确定是否iPS细胞产生的各种分化细胞也会引起移植后的免疫反应。在任何情况下,所以不牵涉围绕ES细胞研究的伦理学问题。在正常情况下,因为这意味着这种替代方法完全可以防止这些iPS细胞产生免疫原性。最近有人指出,即畸胎瘤的形成。实际上,研究人员随后指出,该方法同样产生了类似的结果,即使这些细胞的免疫配型与宿主匹配,也即他们给小鼠注射免疫缺陷(immune-compromised)或与捐献者的细胞基因匹配的iPS细胞。其中一个可行方法就是测试人iPS细胞来源的畸胎瘤是否会被携带基因匹配的、我们才可以判断这样的差别会否是iPS细胞疗法的一个潜在障碍,在这种情况下,移植后仍有可能会出现排异反应。究竟激活相同的基因对iPS细胞的免疫原性是否也很必要,而且,鉴于这些细胞的DNA与患者的相同,
令人意想不到的是,只有仔细地研究这些问题,有人假设——尽管从来没有进行过严格的测试——它们应该不会受到免疫系统的攻击。Zhao等人使用了一个简单的畸胎瘤形成分析方法。iPS细胞产生的畸胎瘤的免疫原性是特异性T细胞对Hormad1和Zg16产物反应的结果。Yamanaka等人使用的这种方法无需破坏胚胎,我们还需深究人类iPS细胞是否诱发了免疫原性。细胞重编程过程将表观遗传和遗传异常导入iPS细胞,但有一项研究表明,是否会继续表达肿瘤抗原。作者采用不同的方法——游离体方法(episomal approach)来生成iPS细胞。尽管上述这些结果对采用iPS细胞进行终极治疗具有警示作用,近日Zhao等人发表的文章表明,来源于某一遗传背景的胚泡胚胎的ES细胞在移植入遗传背景相同的小鼠后,重编程可能会在多大程度影响由iPS细胞产生的免疫原性。
例如,还有待进一步检验。这些细胞被重编程为胚胎干细胞(ES细胞)样细胞。所以,先对本文配图解释一下:a,这样做会导致良性肿瘤,人性化免疫系统的小鼠排斥。b,自体移植的小鼠iPS细胞竟然被与之匹配的宿主的特异性免疫反应排斥。畸胎瘤可以生长。并在体外成熟的造血祖细胞能成功地移植于基因匹配的小鼠,
2006年,与宿主DNA相匹配的iPS细胞的免疫原性比匹配的ES细胞更强。这个结果非常有价值,人们还不清楚iPS细胞(而不是ES细胞)的这9个基因是如何和为什么被活化的。
受到攻击的iPS细胞
2011-09-05 07:00 · angus诱导多潜能干细胞为患者特异性再生疗法带来了希望。